2022年3月22日,bet体育365官网正规夏宁邵教授团队在《自然》子刊《自然•通讯》(Nature Communications)上发表题为“Structures of pseudorabies virus capsids”的研究论文。该论文首次揭示了疱疹病毒科α家族的伪狂犬病毒(pseudorabies virus, PRV)不同类型核衣壳的近原子分辨率结构,以及衣壳相关皮层蛋白复合体(capsid-associated tegument complex, CATC)、基因组进出门户蛋白复合体(portal complex)的原位结构,阐明了PRV衣壳装配以及病毒基因组包装、稳定和释放机制,为PRV抗病毒药物和PRV作为溶瘤病毒药物的研究提供重要信息支持。
PRV又称猪疱疹病毒Ⅰ型病毒,属于α疱疹病毒家族。该病毒能引起多种家畜和野生动物以发热、奇痒及脑脊髓炎为主要特征的急性传染病。猪是 PRV 的天然宿主,PRV 感染猪会导致严重的病毒性脑炎、呼吸窘迫、生长和育肥猪的生长受阻、母猪繁殖障碍和新生仔猪死亡等现象,给全球养猪业带来严重经济损失。此外,PRV 对人类健康的危害也不容忽视,近年来,由 PRV 跨越种属屏障感染人类造成病毒性脑炎的报道说明该病毒已产生新的疾病负担。为此,该团队已开展了PRV抗病毒药物研究,发现阿德福韦酯是一种可治疗PRV感染的有效分子(Antiviral Res. 2021;186:105014)并申请了发明专利。此次研究解析了PRV的病毒颗粒核衣壳结构,为抗病毒药物的进一步筛选和优化提供了重要的结构信息。
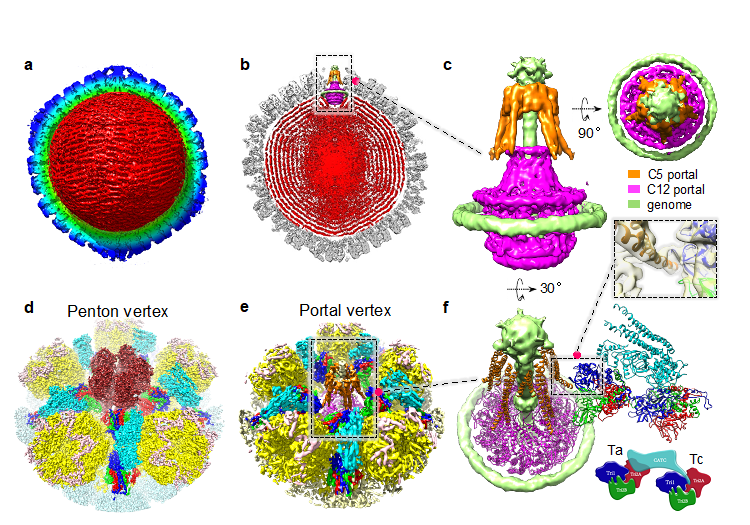
PRV是一种结构及生活史均较复杂的疱疹病毒,衣壳直径约为125 nm,其结构复杂,组装形式多样,纯化难度大,是结构生物学领域的研究难点之一。PRV病毒衣壳不仅能保护基因组,在病毒组装、成熟、侵染等过程中均发挥重要作用。bet体育365官网正规夏宁邵教授团队通过对PRV病毒培养以及纯化方式的大量摸索,成功制备高纯度的PRV病毒颗粒。应用冷冻电镜(Cryo-EM)及局部重构技术(localized reconstruction),首次获得了PRV实心病毒衣壳(C-capsid)及空心病毒衣壳(A-capsid)的近原子分辨率结构,揭示了精细的衣壳组装与结构特征信息。结构显示该病毒衣壳主要由衣壳蛋白(MCP)、次要衣壳蛋白(SCP),以及构成异源三聚体的Tri1和Tri2蛋白组成T=16的二十面体对称结构;MCP形成的五聚体(penton)和六聚体(hexon),是构成衣壳的最主要成分,其中的六聚体由其顶部覆盖的六个SCP蛋白进一步稳固,五聚体和六聚体间的缝隙则由异源三聚体Triplex稳固。PRV衣壳五聚体和六聚体交界面的相互作用较弱,与该团队前期报道的同属α疱疹病毒家族的水痘-带状疱疹病毒(Nat Microbiol. 2020;5(12):1542-1552)类似,但区别于其他人类疱疹病毒。
此外,该研究首次阐明了C-capsid上的衣壳相关皮层蛋白复合体CATC以及基因组进出门户蛋白(portal)的原位结构,发现PRV 门户蛋白的整体结构与α-疱疹病毒HSV-1高度相似,portal和其他相关蛋白的相互作用方式与γ-疱疹病毒显著不同。这些信息提示了PRV衣壳装配以及病毒基因组包装、稳定和释放机制,丰富了疱疹病毒的基础病毒学知识,有利于PRV抗病毒药物和基于PRV的溶瘤病毒药物及疫苗等研究。
bet体育365官网正规博士后王国松、硕士生查正辉、博士生黄鹏飞、博士生孙辉为该论文的共同第一作者;bet体育365官网正规夏宁邵教授、李少伟教授、陈毅歆副教授、郑清炳高级工程师为该论文的共同通讯作者。该研究获得了国家自然科学基金、厦门市科技重大专项的资助。
论文链接:https://www.nature.com/articles/s41467-022-29250-3
(国家工程中心)