近日,bet体育365官网正规夏宁邵教授团队在《细胞》子刊《细胞•宿主与微生物》(Cell Host & Microbe)上在线发表题为“Cryo-EM Structures Reveal the Molecular Basis of Receptor-Initiated Coxsackievirus Uncoating”的研究论文。该研究阐明了柯萨奇B组病毒(Coxsackievirus B,CVB)与其高度依赖的功能性受体柯萨奇病毒-腺病毒受体(Coxsackievirus and Adenovirus Receptor,CAR)相互作用及变构过程的精细特征,从分子水平上揭示了CAR介导CVB病毒高效脱衣壳的作用机制与关键位点,并指引发现了可模拟受体作用特征诱导CVB成熟病毒颗粒失稳及崩解的独特的高效治疗性抗体。这是夏宁邵教授团队近年来在《自然•通讯》(Nature Communications,2017)、《科学•进展》(Science Advances,2018)、《自然•微生物学》(Nature Microbiology,2019)和《细胞•宿主与微生物》(Cell Host & Microbe,2020)上发表肠道病毒重要病原体CVA6、CVA10、EVD68和CVA16研究论文后的又一项重要研究成果,可为CVB疫苗及抗病毒药物研究提供关键基础,丰富了对病毒与受体相互作用机制的认识,为开发靶向病毒受体结合域的高效广谱抗病毒药物提供重要参考和理论基础。
柯萨奇B组病毒(CVB)是可导致多种严重疾病的肠道病毒病原体,可通过粪口等途径传播,传染性强,可感染婴幼儿、青少年及成年人,在全球存在广泛流行。CVB有6种血清型(CVB1~6),均可引发重要疾病,包括发热、手足口病、腹泻、脑炎、脑膜炎、心肌炎、胰腺炎、急性弛缓性麻痹等,甚至死亡。研究发现,CVB感染与近年来发病率不断上升的病毒性胰腺炎、病毒性心肌炎存在密切联系,是导致I型糖尿病和青少年心源性致死的主因之一,具有严重的危害性。开展CVB防治的重要性和公共卫生意义已被高度重视,但目前尚无CVB特效治疗药物和预防疫苗,相关药物是当前抗肠道病毒研究的重要方向。然而,目前对于CVB的基础病毒学特别是潜在的高效抗病毒靶标及效应分子作用机制仍缺乏清晰认识,严重制约了相关研究的有效开展。
CAR是CVB感染作用高度依赖的功能性细胞受体,也被称为脱衣壳受体(Uncoating receptor)。CAR结合可诱导CVB成熟病毒颗粒的不可逆变构进而促进核酸释放,在CVB感染中具有关键作用。CVB-CAR结合域是发现广谱抗病毒靶标的理想目标。然而,目前对CVB与CAR相互作用的精确特征与详细作用机制仍缺乏清晰认识,也尚未发现并精确鉴定CVB的CAR结合域潜在的高效抗病毒表位的精确信息及靶向性中和抗体,是研制新型疫苗或抗病毒药物亟需解决的核心科学问题。
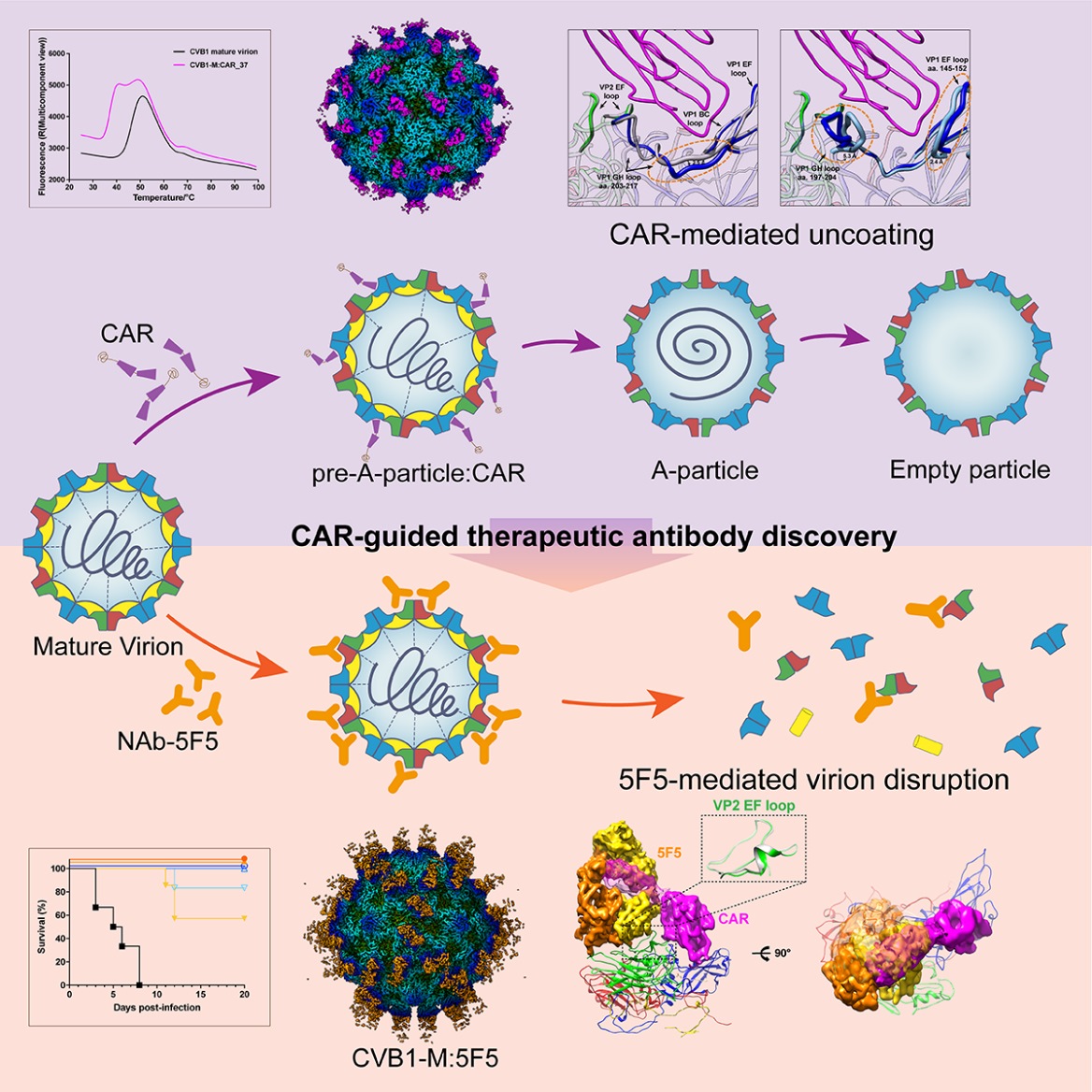
该研究通过构建并解析CVB病毒颗粒及与CAR受体复合物的高分辨率结构,获得在中性pH条件下的一系列代表病毒感染不同阶段的近原子分辨率结构,包括CVB1成熟颗粒(Mature virion)、低温和生理温度下CAR结合的CVB1前体脱衣壳中间态(Pre-A-particle)、脱衣壳中间态(A-particle)和空心颗粒(Empty particle),捕捉到CVB成熟病毒颗粒脱衣壳过程的多种不同中间态及CAR受体相互作用域的一系列的精细构象变化特征。研究显示,CAR结合在病毒表面由衣壳蛋白VP1形成的五倍轴周围的“峡谷”(canyon)区域,相比于其它已知的肠道病毒脱衣壳受体,CAR结合更为深入峡谷凹槽部分,在生理中性pH条件下即可诱导峡谷内部VP1疏水“口袋”(pocket)的塌陷,使得疏水口袋内部维持肠道病毒颗粒稳定性的脂质分子(又称“口袋因子”,pocket factor)释放,从而启动成熟病毒颗粒的脱衣壳进程,推动病毒进一步变构成脱衣壳中间态及空心颗粒,完成病毒完整的脱衣壳及基因组释放过程。该研究阐释了CAR结合驱动CVB感染的分子作用机制,揭示了CVB与CAR之间精确的相互作用方式、结构域特征与关键氨基酸位点,发现受体结合域上可作为潜在高效抗病毒靶标的结构域与关键位点。基于上述发现的指引,该研究筛选到可模拟受体作用特征诱导CVB成熟病毒颗粒失稳及崩解的独特的高效中和抗体5F5。研究发现,5F5可通过空间位阻效应阻断或竞争CAR与CVB的相互作用,不仅能够模拟受体与病毒颗粒的相互作用,还可以通过诱导受体CAR结合域的关键靶点VP2 EF-loop的构象变化从而破坏病毒衣壳的稳定性,并最终导致成熟病毒颗粒裂解而发挥高效的中和作用。
该研究丰富了肠道病毒感染及与受体相互作用机制的基础理论,发现受体结合域的关键抗病毒靶标的精确信息和效应抗体分子,对开展新型疫苗免疫原和抗病毒药物的理性设计和应用开发具有重要价值和意义。
bet体育365官网正规博士后徐龙发、郑清炳高级工程师、博士生朱瑞、博士生尹志超、俞海副教授为该论文共同第一作者。bet体育365官网正规夏宁邵教授、程通教授、李少伟教授和美国加州大学洛杉矶分校纳米系统研究所Z. Hong Zhou(周正洪)教授为该论文的共同通讯作者。该研究获得了国家自然科学基金、新药创制国家科技重大专项、传染病防治国家科技重大专项、国家博士后科学基金资助项目和美国国立卫生研究院基金的支持。
论文链接:https://www.cell.com/cell-host-microbe/fulltext/S1931-3128(21)00001-9
(国家中心)