
9月7日,夏宁邵教授团队在《自然》子刊《自然•微生物学》(Nature Microbiology)上发表题为“Near-atomic cryo-electron microscopy structures of varicella-zoster virus capsids”的研究论文。该研究首次揭示了疱疹病毒α家族的水痘-带状疱疹病毒(VZV)不同类型核衣壳的近原子分辨率结构,阐明了VZV核衣壳不同组成蛋白的相互作用网络与衣壳装配机制,可为进一步开展新型载体疫苗设计及抗病毒药物等研究提供重要支持。
VZV是一种广泛存在并且具有高度传染性的人类α-疱疹病毒。初次感染VZV可导致水痘,人群普遍易感(感染率约为61% ~ 100%)。该病毒可在背根神经节潜伏感染,持续终生。水痘在全世界造成了巨大的疾病负担,每年至少有1.4亿新发水痘病例、420万水痘严重并发症病例以及4200死亡病例。此外,近三分之一的VZV感染者在年老时会因潜伏于神经的VZV重新激活而引起带状疱疹,通常伴有剧烈的神经痛,即使治愈后还会发生后遗神经痛,严重影响患者的生活质量。水痘和带状疱疹还会在新生儿与免疫缺陷人群中导致严重的危及生命的并发症。当前,VZV防治方法仍存在重大挑战,尚无特效治疗药物,现有疫苗存在仍保留神经毒力的风险隐患和适用人群限制等问题。由于VZV是一种结构及生活史均较复杂的疱疹病毒,研究难度较大,目前对VZV的颗粒结构组装、复制和潜伏复发等依然缺乏全面和清晰的认识,严重制约了相关新药研发。衣壳装配是病毒生活周期的关键步骤,是寻找和设计抗病毒药物的良好靶标。近年来,随着冷冻电镜(Cryo-EM)等技术的迅速发展,已有多种人类疱疹病毒的高分辨率衣壳结构获得解析。然而,由于VZV存在体外培养滴度低、细胞结合性强等特性,难以获得足够且高纯度的病毒颗粒,长期以来一直制约了相关研究的开展,目前仍然缺乏关于VZV衣壳颗粒的精确结构、蛋白组成及其相互作用机制的系统认识。
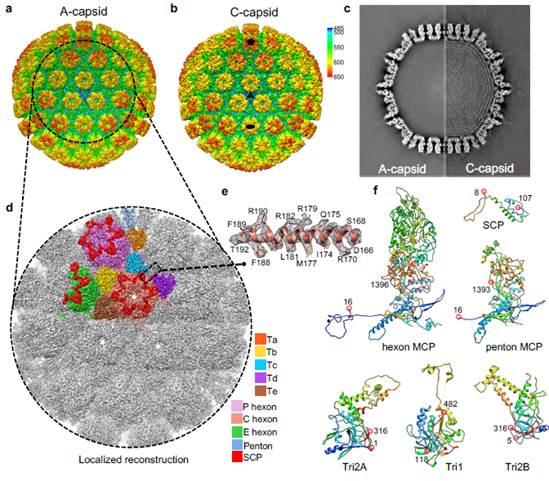
夏宁邵教授团队长期开展VZV相关基础与新型疫苗研究,通过系统和精细探索建立了高效的VZV规模化培养和病毒颗粒纯化技术体系,成功获得高质量的VZV颗粒样品。发现VZV衣壳主要存在两种颗粒类型,分别为包含病毒核酸的成熟衣壳与不含核酸的空心衣壳。应用冷冻电镜技术与局部重构(Localized reconstruction)技术首次获得了两种衣壳的近原子分辨率结构,分辨率分别为4.1 Å和3.5 Å,提供精细的衣壳组成与结构特征信息。VZV两种衣壳颗粒的结构特征总体相似,与同属人类α疱疹病毒的单纯疱疹病毒(HSV)衣壳整体结构也存在较多相似之处,提示了通过靶向共有关键相互位点发现人类疱疹病毒潜在的广谱抗病毒靶标的可能性。研究发现,与其它已知疱疹病毒衣壳不同,VZV衣壳具有更多的柔性区域,且衣壳蛋白之间、衣壳与皮层蛋白之间的相互作用均相对较弱,但VZV衣壳仍然具有与其它疱疹病毒衣壳相当的结构稳定性,这可能与VZV具有人类疱疹病毒中最小的基因组有关。VZV衣壳具有人类疱疹病毒中最大的小衣壳蛋白(SCP),该蛋白对VZV感染必不可少,其结构具有独特的、延伸至VZV病毒颗粒皮层的柔性C端区域,该区域与VZV衣壳出核和包膜组装直接相关。此外,此次研究还发现VZV基因组最外层有部分插入到由主要衣壳蛋白(MCP)组成的六邻体腔内,目前仅在具有疱疹病毒家族最大基因组的人巨细胞病毒(HCMV)衣壳有发现类似现象,研究提出这种特殊的基因组排列特征可能与病毒基因组和衣壳六邻体腔内部的分子静电作用相关,而不仅仅是此前认为的与病毒基因组大小相关。此次研究填补了人类α疱疹病毒VZV结构信息空白,为揭示不同疱疹病毒结构异同点并进一步研究该类病毒组装的共性问题提供重要基础,也为广谱抗病毒药物和新型疫苗的研制提供科学线索和理论依据。
另外,夏宁邵教授团队长期开展VZV致病机理与新型水痘减毒活疫苗研究,近年来取得一系列进展:发现VZV可导致合胞体细胞的细胞核膜发生融合作用,揭示了VZV感染后细胞病变的新特征(Virology 2017);基于人胚肺嵌合小鼠建立了VZV人胚肺体内感染模型,可用于支持VZV对人肺脏的感染与致病机制研究(Antiviral Research 2017);发现皮层蛋白ORF7与VZV衣壳之间存在相互作用,可能影响VZV衣壳在细胞质内的二次包膜与组装成熟(Journal of Virology 2017);基于类病毒颗粒联合展示VZV与人肠道病毒71型(EV71)优势中和表位的新型表位疫苗(Vaccine 2017);揭示VZV皮肤与神经趋向性因子ORF7与重要皮层蛋白ORF53的相互作用,为VZV致病机制研究提供基础(Virologica Sinica 2017)。此次发表的研究成果有望为深入了解VZV衣壳与关键毒力因子的互作关系,进一步系统揭示病毒感染与致病机制提供重要支持。在VZV新型疫苗研发方面,与万泰生物合作开发基于反向遗传学技术构建了敲除ORF7的皮肤与神经双减毒的新型水痘减毒活疫苗(VZV-7D),已进入IIa期临床试验阶段。
博士后王玮、高级工程师郑清炳、博士生潘德全和俞海副教授为该论文共同第一作者,夏宁邵教授、程通副教授、李少伟教授以及美国罗格斯大学朱桦(Hua Zhu)教授、加利福尼亚大学洛杉矶分校周正洪(Z. Hong Zhou)教授为该论文的共同通讯作者。该研究获得了国家自然科学基金、新药创制国家科技重大专项和传染病防治国家科技重大专项等资助。
论文链接:https://www.nature.com/articles/s41564-020-0785-y
(学院办公室 欧明展)